新政下各试验项目企业所需提供材料及注意事项
栏目:行业新闻
发布时间:2018-12-13
新政策下,现今各试验项目除去室内活性、配方筛选和室内抗性三项外,其余均需在符合资质的试验单位进行,并且需要符合GLP和GEP规范要求。试验流程上的改变以及试验报告格式的改变,导致在试验安排以及出具报告时需要企业提供的材料进行了改变。见下表。
新政策下,现今各试验项目除去室内活性、配方筛选和室内抗性三项外,其余均需在符合资质的试验单位进行,并且需要符合GLP和GEP规范要求。试验流程上的改变以及试验报告格式的改变,导致在试验安排以及出具报告时需要企业提供的材料进行了改变。见下表。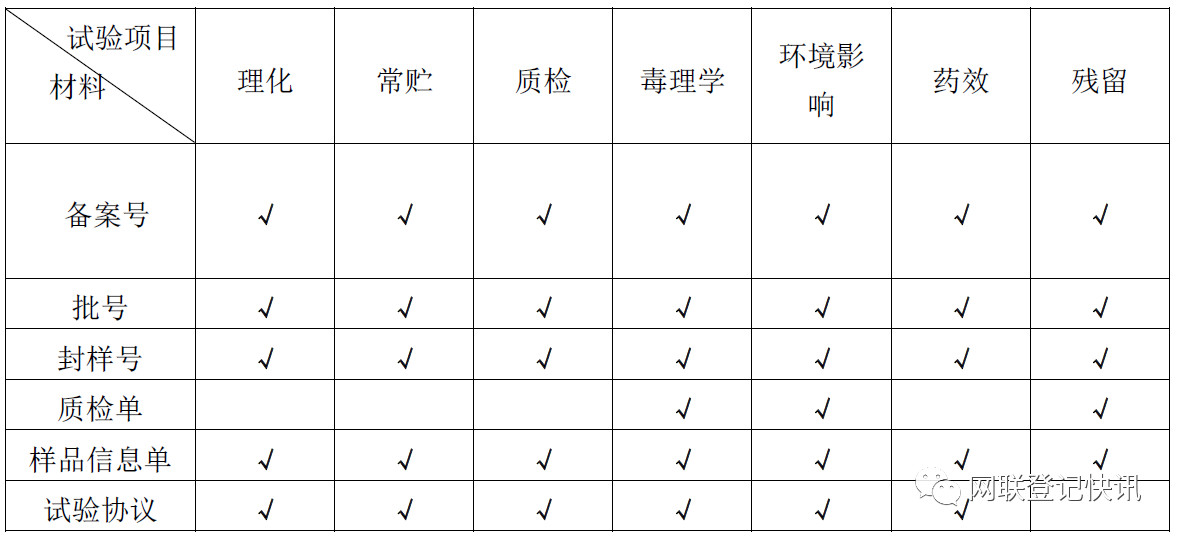
以上各材料的相关注意事项如下:
一、备案号、批号和封样号
① 一般而言,企业在登记之前在当地省所进行样品封样时,所封的样品为同一批次的样品,因此,以上各试验项目的样品封样号和批号理论上应保持一致。若之后重新封样进行试验,需注意试验报告上封样号和批号也要随之改变。
② 试验开始时间一般晚于封样号对应的封样日期;批号对应的生产日期,一般农药为两年保质期(微生物农药一般为1年),这就要求企业在第二年进行试验安排时注意样品是否过了保质期,是否需要重新封样。
③ 试验备案为一年一备案,即两年试验有两个备案号。备案时涉及到填写封样号和封样日期,若样品重新封样即封样号与封样日期进行改动,则需将该样品所要进行的试验重新备案。
二、质检单
企业封样时需要提供企业盖章的质检单作为封样样品合格的依据。在安排急性毒理、环境毒理以及残留试验时需要向试验单位提供该质检单扫描件或复印件用以附在报告后面。
三、样品信息单
1.药效试验
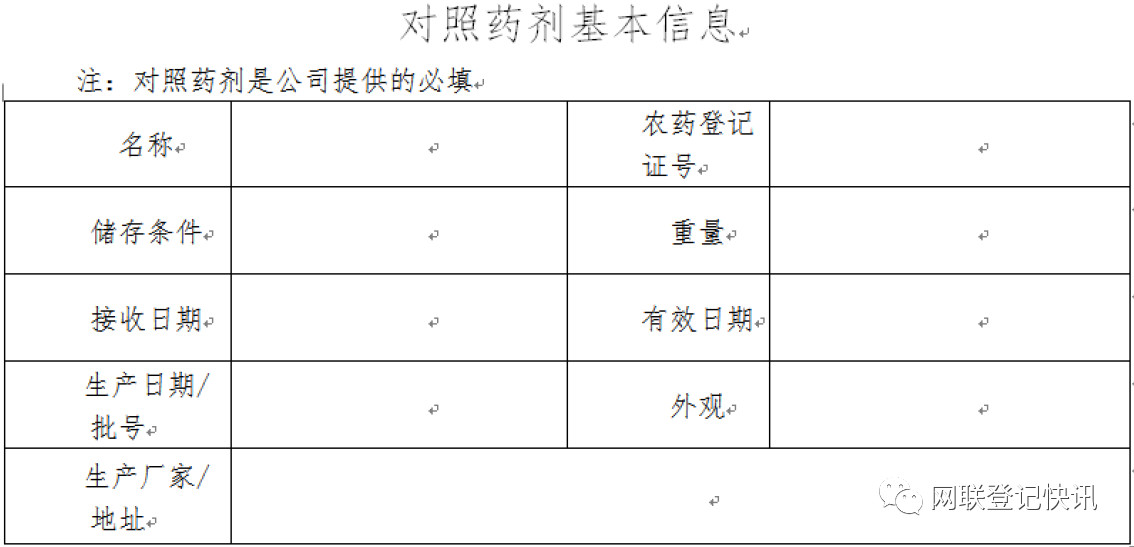
由于今后药效试验对照药剂需要企业自行提供,则试验药剂和对照药剂的样品信息都需要填写,一般需要提供以下内容: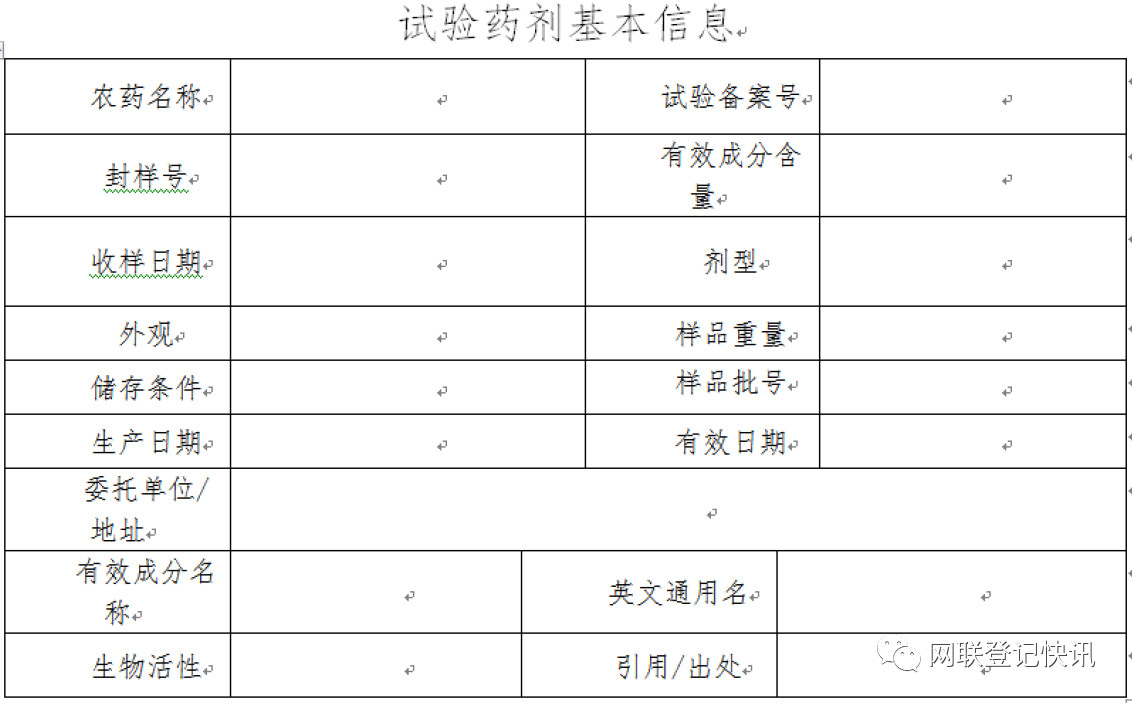

3.理化、质检、常贮、毒理、环境试验
由于不同试验单位有不同的信息单模板,所需提供的内容不一样。相比于以上药效两表多了CAS号、结构式、包装材质等相关信息。
四、试验协议
企业与试验单位签订的协议复印件,出具报告时附在试验报告后面。

 0531-81181266
0531-81181266

